ARTICULO DEL MES DE AGOSTO DE 2021
“Olaparib adyuvante en pacientes con cáncer de mama brca1 y brca2 mutado A.N.J. Tutt NEJM 2021”
Dr. Diego Carrillo. Residente de Oncología Médica. Pontificia Universidad Católica de Chile.Santiago,Chile
Introducción
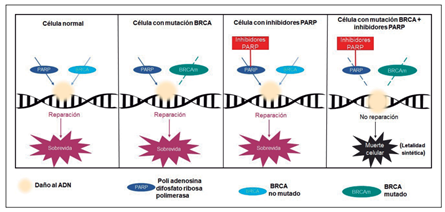
Mantener la integridad del ADN es un proceso biológico muy relevante, por lo cual, en una célula normal, sus mecanismos de reparación son variados (Redundantes). Una vía de reparación es aquella en que participan los genes BRCA 1 y 2. Mutaciones germinales (hereditarias) de estos genes pueden estar presentes en un 5-10 % de pacientes con cáncer de mama (CM). Otra vía de reparación del ADN es la que utiliza una enzima llamada PARP. La inhibición de PARP, por tanto, es particularmente efectiva en neoplasias que tienen alteraciones de la reparación del ADN por otros mecanismos PARP independientes, como son aquellas células con mutaciones de BRCA (Figura 1), induciendo en estas células muerte celular, a través de un fenómeno llamado letalidad sintética. Los inhibidores de PARP(PARPi) han demostrado ser activos en CM avanzado con mutación de BRCA1 o BRCA2. Este trabajo, recientemente publicado en el NEJM, buscó determinar si el uso de inhibidores de PARP (PARPi) en pacientes con CM localizado, reduce la posibilidad de recurrencia.
Métodos:
Estudio fase 3, randomizado y controlado, incluyó pacientes con mutaciones germinales patogénicas de BRCA1 o BRCA2, y CM HER2 -, de alto riesgo clínico-patológico, que recibieron tratamiento local y quimioterapia neoadyuvante o adyuvante. Se consideró de alto riesgo aquellos pacientes sometidos a cirugía de entrada con enfermedad al menos pT2 o N + para los tumores triple negativos; mientras que en tumores RE +, se exigió la presencia de al menos 4 linfonodos con compromiso histológico. En los pacientes que recibieron terapia neoadyuvante, se consideró de alto riesgo la presencia de enfermedad residual para tumores triple negativos, mientras que en tumores RE +, se consideró enfermedad residual con un índice CPS-EG de al menos 3. Los participantes fueron randomizados a recibir olaparib o placebo (1:1) por un año. El objetivo primario fue la sobrevida libre de enfermedad invasora (SLEI).
Resultados:
Se randomizaron 1836 pacientes. Se realizó un análisis interino pre-especificado, con una media de seguimiento de 2.5 años. La SLEI a 3 años fue de 85.9% en el grupo de olaparib comparado con 77.1% en el grupo placebo (HR de 0.58 para enfermedad invasiva o muerte, IC 99.5% 0.41 a 0.82, p<0.001). La sobrevida libre de enfermedad a distancia (SLED) fue de 87.5% en el grupo de olaparib comparado con un 80.4% en el grupo placebo (HR de enfermedad a distancia o muerte de 0.57, con IC 99.5% 0.39 a 0.83, p<0.01). En el grupo de olaparib hubo 59 muertes, mientras en el grupo placebo 68, diferencia que no alcanzó significancia estadística (HR 0.68, con IC 99% 0.44 a 1.05, p=0.02). No se reportaron efectos adversos serios fuera de la toxicidad por olaparib conocida.
Conclusiones:
Los autores sugieren que en pacientes con CM localizado de alto riesgo, HER2- con mutaciones germinales de significado patogénico en BRCA1 o BRCA2, que hayan recibido tratamiento local y quimioterapia, el uso de olaparib se asocia con mejor SLEI y SLED en comparación con placebo, sin un impacto mayor en la calidad de vida.
Este estudio subraya la relevancia terapéutica del estudio de mutaciones germinales en pacientes con CM y nos obliga a mejorar la estrategia y acceso para el estudio de mutaciones germinales en nuestro medio. No sabemos aún si todos los pacientes con mutaciones patogénicas de BRCA se benefician de PARPi, o existe un grupo específico con mayor beneficio. Dado el uso creciente de platino en neoadyuvancia, capecitabina en adyuvancia y de esquemas perioperatorios con reguladores de puntos de control inmune (anti-PD1 o PDL1), es incierto el rol de PARPi en estos diferentes escenarios. Un mayor seguimiento del estudio permitirá determinar los riesgos hematológicos en el largo plazo asociados al uso de PARPi (leucemia/mielodisplasia). La ausencia de beneficio en sobrevida global y los costos asociados al tratamiento son aspectos relevantes a considerar en la toma de decisiones.
Figura 1, Mecanismo acción de inhibidores PARP (poli-adenosina difosfato ribosa polimerasa).
1. Tutt ANJ, Garber JE, Kaufman B, Viale G, Fumagalli D, Rastogi P, Gelber RD, de Azambuja E, Fielding A, Balmaña J, Domchek SM, Gelmon KA, Hollingsworth SJ, Korde LA, Linderholm B, Bandos H, Senkus E, Suga JM, Shao Z, Pippas AW, Nowecki Z, Huzarski T, Ganz PA, Lucas PC, Baker N, Loibl S, McConnell R, Piccart M, Schmutzler R, Steger GG, Costantino JP, Arahmani A, Wolmark N, McFadden E, Karantza V, Lakhani SR, Yothers G, Campbell C, Geyer CE Jr; OlympiA Clinical Trial Steering Committee and Investigators. Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med. 2021 Jun 24;384(25):2394-2405. doi: 10.1056/NEJMoa2105215. Epub 2021 Jun 3. PMID: 34081848.
2. Luque Sulbaran G, Walbaum García B, Camus Appuhn M, Domínguez Covarrubias F, Merino Lara T, Acevedo C F, Sánchez Rojel C. Cáncer de mama triple negativo: terapias sistémicas actuales y experiencia local. Rev. Cirugia. 2021;73(2). Disponible en: doi:10.35687/s2452-45492021002942
3. Tung NM, Zakalik D, Somerfield MR; Hereditary Breast Cancer Guideline Expert Panel. Adjuvant PARP Inhibitors in Patients With High-Risk Early-Stage HER2-Negative Breast Cancer and Germline BRCA Mutations: ASCO Hereditary Breast Cancer Guideline Rapid Recommendation Update. J Clin Oncol. 2021 Aug 3:JCO2101532. doi: 10.1200/JCO.21.01532. Epub ahead of print. PMID: 34343058.
Dr. Diego Carrillo
Residente de Oncología Médica
Pontificia Universidad Católica de Chile
